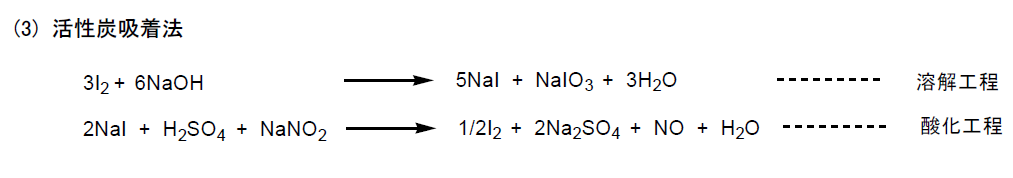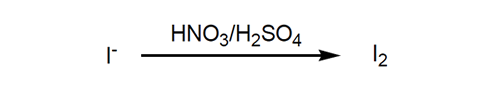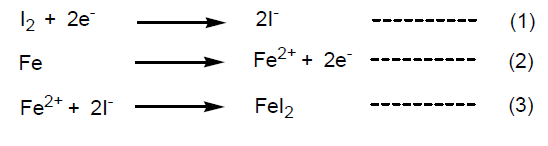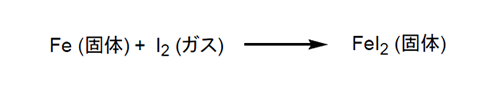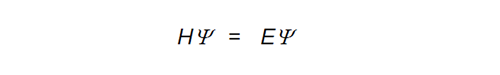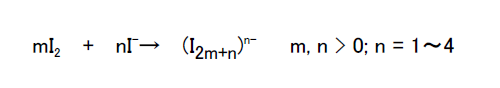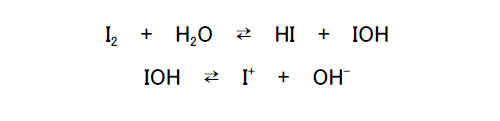ヨウ素とは
これはヨウ素学会顧問横山正孝氏(千葉大学名誉教授)から『古くて新しいヨウ素科学』の題名で寄稿されたもので、基礎から最近の応用まで平易に解説されています(2009年8月)。
今般、ヨウ素学会特別会員横山正孝氏(千葉大学名誉教授)がヨウ素学会顧問石川勉氏(千葉大学名誉教授)の協力を得て改版し、「ヨウ素はどのようにして製法されるか」や「有用な天然物の合成に利用される」など6章を新たに加筆されています(2018年12月)
※なお、ページ内の画像をクリックすると拡大します。
1) はじめに
多くの人がヨウ素と聞いて思い浮かべるのは、デンプンの検出に使う“ヨウ素デンプン反応”と外傷の手当てに使う“ヨードチンキ”であろう。このように、昔から知られているヨウ素の働きは包接性とか殺菌性とか現象論的性質で解釈されてきた。しかし、21世紀になり突如注目されてきた液晶ディスプレーに使われる偏光フィルムや太陽電池の電解液、また、有機合成の酸化剤としての多配位ヨウ素化合物のヨウ素の役割を考える場合には、現代の電子論的考察が必要となる。
ヨウ素は元素の周期律表からハロゲン元素に属するが、他のハロゲン元素であるフッ素、塩素、臭素がテフロン樹脂、フロン、DDT、ダイオキシン、難燃性臭素ポリマーとかで最終物質に顔を見せている主役的存在に対して、ヨウ素は反応試剤とか反応中間体、あるいは生体内の甲状腺ホルモン(チロキシン)とか地味な影武者的存在である。この脇役的存在のヨウ素を現代の科学的手段で眺めれば、新たな科学が開けるかもしれない。しかも、ヨウ素は世界の 1/3 を日本が産出しているのである。資源少国の我国としては、注目しなければならない非常に貴重な資源である。
超原子価ヨウ素化合物が有機合成に使用されるのを契機として、千葉に“ヨウ素利用研究会 [Forum on Iodine Utilization: FIU:現在はヨウ素学会 (Society of Iodine Science: SIS)]”が立ち上った。この目的は、新しいヨウ素科学を産学協同で研究することであった。現在、地上デジタル放送移行で液晶ディスプレーが大いに売れている。また、色素増感太陽電池の電解液として大量需要が見込まれている。しかし、ヨウ素の資源には限界がある。世界でこの資源の大部分を担っているのは、科学立国を称する日本なのである。
2) ヨウ素資源は如何に生成したか
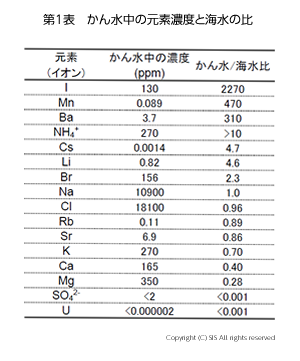
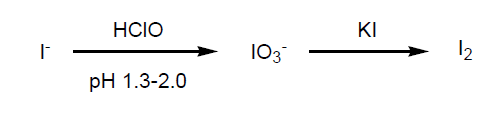
ヨウ素 (I) はクラーク数 64番目の元素で、17番目のフッ素 (F)、11 番目の塩素 (Cl)、46番目の臭素 (Br)と同じハロゲン元素の中でも非常に貴重な資源なのである。地球の地殻にある全量は 8.6 x 1012 トンと言われており、その中の 70% は海洋堆積物の中にある。日本のヨウ素の大部分は、千葉県茂原地区から天然ガスの採取と一緒に産出される。このヨウ素は、太古の藍藻、珪藻やそれを食した生物が地下に沈み、地球の地下熱で還元的分解を受けて生成したものと考えられている。地名の由来のように、この地区は藻類が茂っていたものと考えられる。地下にパイプを挿入し天然ガス採取の際に、海水より溶解塩分が多い “かん水”と言われる水を伴うが、その中にヨウ素イオン (I–) が多量に存在する。その “かん水” から塩素あるいは次亜塩素酸ナトリウムで酸化しヨウ素 (I2) を得て、残りの “かん水” は地盤沈下を防ぐために地下に戻すのである(第1表)。
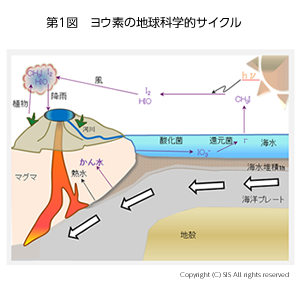
天然ガスを採取する地層は地球化学的に100-200万年前のもので、今まではこの年代にヨウ素が生成したと、考えられていた。しかし近年、村松教授(学習院大学)のヨウ素放射性同位体 (12953I) を用いた分析結果から、ヨウ素生成は4900万年前であると計算された。そして4900 万年前に海底に堆積した藻類や生物の死骸を持つ海洋プレートの沈み込みが 100-200 万年前の地層に起こったと考えて説明している。しかし、この結論を出すには、同時に産出する天然ガスのメタンの炭素放射性同位体 (146C) の分析結果や他の科学情報も必要かもしれない(第1図)。
一方、世界の半分のヨウ素を産出しているチリのアンデス山脈は、海洋プレートの沈下で隆起し出来たものである。ここで採取される硝酸ナトリウムを含むカリーチ鉱石中のラウタライト[Ca(IO3)2] 及びディーゼアイト [7Ca(IO3)2・8CaCrO4] 鉱石が粉砕され、水抽出によりヨウ素が得られている。ここのヨウ素資源の生成は日本のそれとは異なり、大気中の次亜ヨウ素酸 (HIO)、ヨウ素、ヨウ化メチル (CH3I) が降雨により岩石へ浸み込むことにより生成したものと考えられている。
地球地殻に存在するヨウ素の 0.8% は海水中にある。海底堆積物から生成するヨウ素酸イオン ( IO3– ) と、それが還元バクテリアの作用でヨウ素イオンとなった形で海水中には 0.06 ppm のヨウ素が存在している。褐藻類のコンブは海水の 3万倍の 1800 ppm のヨウ素イオンと、少量の下に示すようなカルバゾールやベンゼンのヨウ素誘導体を含んでいる。
海水中のヨウ素濃度は地球化学的サイクルで一定に保たれていると推定されている。即ち、ヨウ素イオンがヨウ素揮発バクテリアによりヨウ化メチルとなり、大気中に放出される。そこで太陽光を受けヨウ素と次亜ヨウ素酸に変化し、降雨とともに川を経て海に戻る循環である(第 1 図)。
3) ヨウ素はどのようにして製法されるか
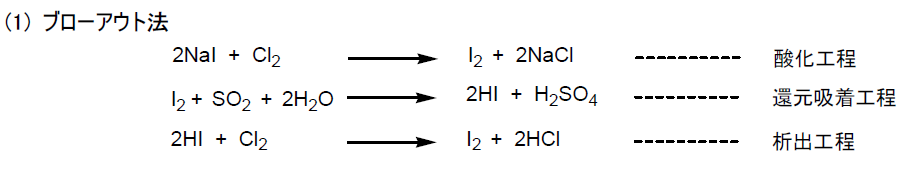
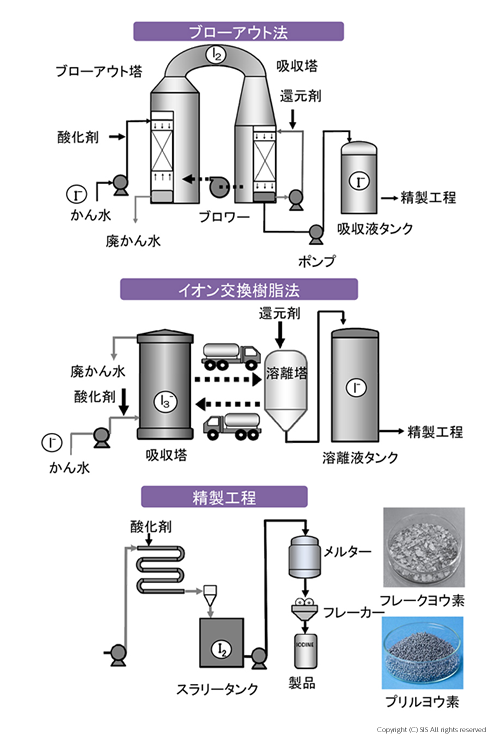
日本では、ヨウ素を次に示す、(1)ブローアウト法と (2) イオン交換樹脂法の二つの方法で製品化している。一方、ロシア、アメリカならびにインドネシアでは、(3) 活性炭吸着法を用いている。
ヨウ化ナトリウム(NaI) を含むかん水を塩素あるいは次亜塩素酸ナトリウムで酸化後、空気でアウトブローしてヨウ素を集め、亜硫酸で還元しヨウ化水素酸 (HI) として、最終的に塩素あるいは次亜塩素酸ナトリウムで酸化して純粋なヨウ素製品とする。
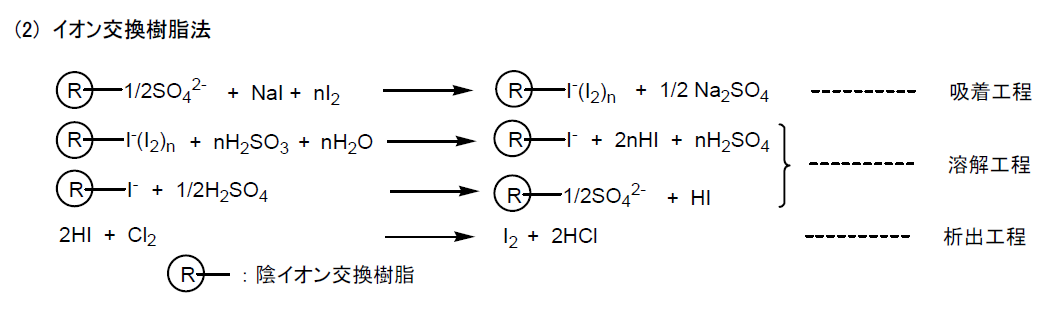
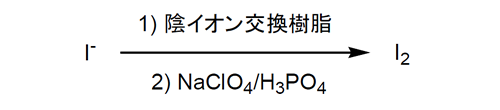
吸着工程で対イオン ( SO42- ) を持つ陰イオン交換樹脂にかん水とヨウ素を流し、ポリヨウ素イオンに交換した樹脂を亜硫酸で還元し、ヨウ化水素酸と硫酸にする。この硫酸で出発陰イオン樹脂を再生すると同時に、得られたヨウ化水素酸を塩素で酸化して純粋なヨウ素を回収する。
溶液中に存在するヨウ素を、活性炭を加え吸着分離し、次に水酸化ナトリウムを加えヨウ化ナトリウムとヨウ化水素酸ナトリウム (NaIO3) の溶液を得る(溶解工程)。この溶液を硫酸で酸性化し、亜硝酸ナトリウムを加え純粋なヨウ素を析出させる(酸化工程)。なお、活性炭は水洗、乾燥して再利用する。
ヨウ素は天然の貴重な資源のため生産には制限が必要である。更に、かん水から生産している日本では地盤沈下そして砂漠地から生産しているチリでは水の問題があり、ヨウ素生産には回収が必要である。現在、ヨウ素を含む使用済み廃液から高温分解法あるいは電気透析法でヨウ素使用量の約 30% を回収して使用している。
4) ヨウ素含量は如何に分析されるか
ヨウ素の分析には、ヨウ素イオンを標的とした (1) 滴定法、(2) 吸光光度法、(3) イオンクロマトグラフ法に加え、直接ヨウ素原子を測定する (4) ICP (Inductively Coupled Plasma) 法の 4 種類の方法が知られている。
(1) 滴定法
ヨウ素イオン (I–) を酸化してヨウ素酸イオンに変えた後、ヨウ化カリウムでヨウ素分子に変換し、ハイポ (Na2S2O3) で滴定する。
(2) 吸光光度法
ヨウ素イオンを硝酸/硫酸で酸化してヨウ素分子に変換し、クロロホルム (CHCl3) あるいは四塩化炭素 (CCl4)の有機溶媒で抽出、吸光光度計で検量線を用い測定する。これら (1) と (2) の方法で 0.1-5 ppmまで測定可能である。
(3) イオンクロマトグラフ法
陰イオン交換樹脂で検体のヨウ素イオンをトラップした後、樹脂を酸化してヨウ素分子に変換し有機溶媒で抽出、紫外・可視吸収スペクトルで定量する。1 ppm の 1/1000の 1 ppb まで測定可能である。
(4) ICP法
生体内の微量ヨウ素の検出方法である。プラズマ化したアルゴン気流を検体に当て、ヨウ素原子を励起させ、基底状態に戻る時の発光スペクトルを測定する (15 ppb まで測定可能)。これに、質量分析器を組合せると 0.001 ppb まで測定できる。
5)ヨウ素にはどんな物理化学的性質があるか
他のハロゲン分子が常温で気体か液体であるのと対照的に、ヨウ素分子は常温で高い沸点 (184 ℃) を持つ黒紫色の安定な結晶で存在する。結晶化した塩素分子 (Cl2)、臭素分子 (Br2) そしてヨウ素分子は分散力(ロンドン力)が分子間に働き凝集した分子状結晶を形成している。この分散力は大きな分子ほど大きく、従って、融点および沸点は F2< Cl2< Br2<I2 の順に高くなっている。ヨウ素分子の分子量は 254 であるので、空気の平均分子量 28.2 に比較して極端に重いために、蒸気は空間では下層に堆積する。ヨウ素分子及びヨウ素化合物の特徴として水への溶解性は低く、臭素分子は 20 ℃ で 100g の水に 3.58 g が溶けるが、ヨウ素分子は 0.02 g しか溶けない。
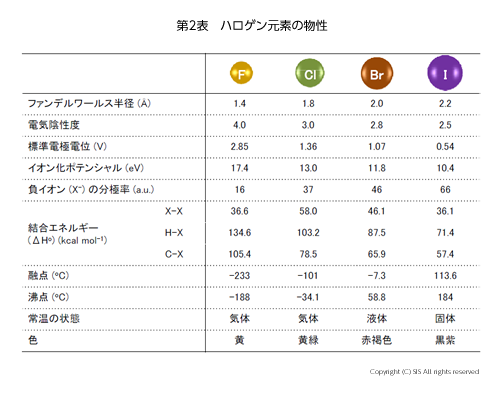
ヨウ素原子 (12753I) は元素の周期律表で53番目の元素に相当している。これは原子量が 127 で53 個の陽子と 74 個の中性子からなる原子核と、その核の直径のおよそ 1万倍の直径を持つ空間に 53 個の電子を有している。これら電子は原子空間にでたらめに存在しているのではなく、ある決められた軌道に存在している。その中で最も原子核から離れた位置にある 5p 軌道という亜鈴型の軌道には 5 個の電子が存在しているが、もう 1個の電子を収容する能力を持っている。しかも、この位置は核から一番離れているので、その束縛から比較的自由に振舞うことが出来る。ハロゲン元素のフロンティア軌道[福井教授(京都大学)が提唱した電子軌道] は、フッ素では 2p 軌道、塩素では 3p 軌道、臭素では 4p 軌道そしてヨウ素では 5p 軌道と、順次原子核から離れて存在するために、ハロゲン元素の化学的性質は似ているが、原子の大きさや電気的性質そして結合性に明らかな違いが表れている(第 2 表)
原子の大きさは、結合していない状態の原子半径(ファンデルワールス半径)を比較すると歴然としている。ヨウ素の大きさはメチル (CH3) 基に近く、生体内で間違って取込まれるのを期待した薬への利用がある。電気的性質としては、原子核に近い軌道の電子は核から強い静電力を受け、電気陰性度や標準電極電位が示すように、電子との親和力は F > Cl> Br > Iの順に小さくなっている。この傾向はイオン化に必要なエネルギーであるイオン化ポテンシャルでも同じである。つまり、ヨウ素はハロゲン元素の中で一番酸化及び還元され易いのである。注目すべきことは、電場内での電子の偏りの容易さは、負イオン (X–) の分極率でわかるが、大きな電子雲を持つヨウ素が一番大きい。これは、ヨウ素イオンが有機反応において大きな求核性や窒素、酸素そして硫黄原子の孤立電子対と弱いハロゲン結合を形成することに関係している。また、分極率の大きなヨウ素イオンはソフトな塩基といわれ、ソフトな酸である銅イオン (Cu+)、銀イオン (Ag+)、水銀イオン (Hg+)、ヨウ素陽イオン (I+) そしてヨウ素分子と安定な結合を形成する。結合の強さは、結合をホモリティックに解離するエネルギー (△Ho) なので、同種の原子間ではあまり差は認められないが、H-X や C-X のような電気陰性度の違う原子間の結合ではハロゲン元素により大きな差が出てきて、ヨウ素との結合が一番弱い。これは、ヨウ素のリサイクル/リユースの容易さを示唆するものである。生体内では、脱ヨウ素化酵素の作用で甲状腺ホルモンのヨウ素をリサイクル/リユースしている。また、ヨウ素の大きな分散力と酸化還元の容易さは、デンプン、ポリビニルアルコール、ポリアセチレン、グラファイト、グラフェン、カーボンナノチューブへの包接力を説明できる。
6)ヨウ素による鉄の腐食を考える
電気化学的考察:ヨウ素は、人工合成金属のテクネチウム (Tc) を除き、全ての金属と反応してそのヨウ化金属を生成する。金属原子から 1個電子をもらうと化学的に安定なキセノン原子 (Xe) の電子構造になり安定化するので、1 電子還元能を持つ。この性質が殆どの金属と反応する性質なのである。その中でも、イオン化エネルギーの小さなマグネシウム (Mg) や鉄 (Fe) は水分の存在下激しく反応してヨウ化物を生成する。
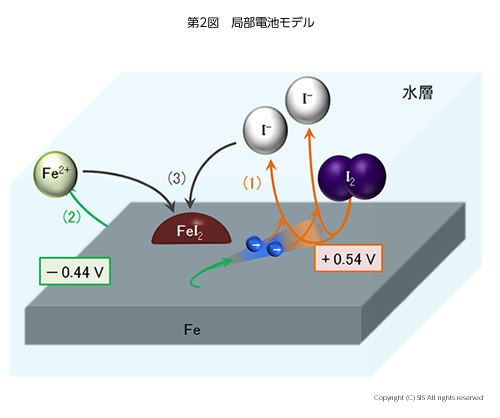
そこで代表例として、ヨウ素が鉄を腐食する反応機構を考えてみよう。腐食に関係した反応は、以下の 3 つの化学反応式で説明できる。
式 (1) は先に述べたヨウ素の1電子還元能を表し、水素のイオン化 (H2→2H++2e–)を基準電位0Vとすると、+0.54Vの電位を持つ。式 (2)の電子放出反応は -0.44Vの電位で起こる。従って、ヨウ素が鉄を腐食する反応 (3) は、+0.54V-(-0.44 V)=0.98Vの局部電池を形成して激しく反応が起こると考えられる。これが電気化学的に説明する腐食機構である(第2図)。
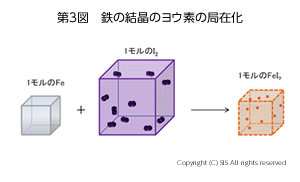
熱力学的考察:この腐食反応を熱力学の観点から考えてみよう。自然界で起こる変化を支配するルールとして熱力学の法則がある。熱量を表すエンタルピー (△H)と乱雑さ(自由度)を表すエントロピー (△S)で物質の変化を考えるのである。熱力学第一法則に従えば、熱量エンタルピー (△H)は宇宙全体から見れば不変である。第二法則として、物質の変化 (△S)は増大する方向に進むとある。ヨウ素による鉄の腐食反応は、鉄にヨウ素が結合することなので明らかに見かけ上△Sは減少する筈である(第 3 図)。
どうしてこの第二法則に反する変化が容易に起こるのだろうか。そこで、この反応を少し詳細に見てみよう。
上の反応の △S は推察通り -204 JK-1mol-1 で負であり減少している。しかし、この反応は発熱反応 (△H = -126 kJmol-1) なのである。ここで生じた熱は熱力学第一法則に従って、周りの空気を暖め外界の△S を増加させている。その増加量は計算すると 422 JK-1mol-1 で、従って、反応系全体では△S = (422-204) JK-1mol-1 = 218 JK-1mol-1 となり正の値をとり、熱力学第二法則に従っている。このように、この反応は△Sと △Hが絡んでくるので考えるのにややこしくなっていたのである。そこで簡単化するためにこの両方の関数から成るギブス関数 (△G)を導入すると、△Gが負の値であれば自然界で起こりうると考えられる。ちなみに、ヨウ素-鉄反応の△G は -65 kJmol-1となる。
ここに登場した△Gは大変便利な値で、電気的な仕事の最大値を表している。つまり、ヨウ素 1モル (254 g) と鉄 1 モル (56 g) との腐食反応から 65 kJ の電気エネルギーが得られることを意味している。これは実用単位に換算すると、1 J = 1 Ws なので 65 kWs となり、例えば、1 kW のモーターを 65 秒回転できる仕事に相当している。
7)ヨウ素の化学結合はどうなっているか
2 個のヨウ素原子が結合してヨウ素分子となる。また、ヨウ素原子が炭素原子やその他種々の原子と結合してヨウ化物をつくる。これら分子中の結合状態はどうなっているのだろうか。化学結合はそれぞれの原子の電子から出来上がっている。従って、ヨウ素原子の電子状態から理解しなければならない。
さて、電子は負の電荷を持つ粒子であることを最初に発見したのは J.J.トムソンである。この粒子の流れが電流であり、この電子の展開が現代の IT 産業の源流になろうとは当時は誰も考えてもみなかったであろう。また、化学反応は原子間の結合が切れたり繋がったりすることなので、結合を構成する電子が主役となる。従って、ポーリングが化学結合論でノーベル賞を受けたのは頷ける。そこで、結合を説明するためには結合を形成している原子が電子を持っているという点から始めなければならない。そもそも、質量数 (m+n) の原子とは m 個の陽子と n 個の中性子からなる原子核 (直径 10-12-10-13 cm) を中心として、そのおよそ 1 万倍の球状空間 (直径 ca 10-8 cm) に m 個の電子を持つものである。電子の質量は 9.1 x 10-28 g で、陽子、中性子の質量はそれぞれ電子のおよそ 1840 倍 (1.67 x 10-24 g) であるので、原子の質量は電子を無視した原子核の質量になっている。陽子は 1.6 x 10-19 クーロン (C)、中性子は 0 C、電子は -1.6 x 10-19 C の電荷があるので、原子全体では電荷は 0 Cの中性である。この原子内の空間に電子はどのように存在しているのかということである。
最初ラザフォードは、電子は原子内の空間に雲のように分散して存在していると考えた。しかし、色々な金属元素の発光および吸収スペクトルの解釈から、電子はとびとびの一定のエネルギーを持つ軌道に存在していると改められたのである。理化学研究所(理研)の長岡半太郎は、世界に先駆けて原子核の周りに電子が回る、いわゆる“惑星モデル”を理研の報告書に述べたが、その後、ボーア一派が類似の詳しいモデルを提出したので、現在はボーアの原子モデルが原子模型ということになっている。しかし、この原子模型ではどうして電子が原子核の周りを永久運動するのかということを説明出来なかった。これは、電子を石や野球のボールのような重さを持つ物質と考えたためで、ハイゼンベルクは彼の提出した不確定性原理の中で、電子のような極めて軽い物質を従来のニュートン力学で取扱うと大きな誤差を生じると述べ、新たな観点から電子の運動を考えねばならなくなった。そこで、フランスのルベルは光と同じように、電子も衝突時は粒子としてそして伝達時は波としての性質を持っているのではないか、と提案したのである。オーストリアのシュレジンガーは、1926 年に電子の運動式を波動関数で表した有名なシュレジンガーの波動方程式を提出した。
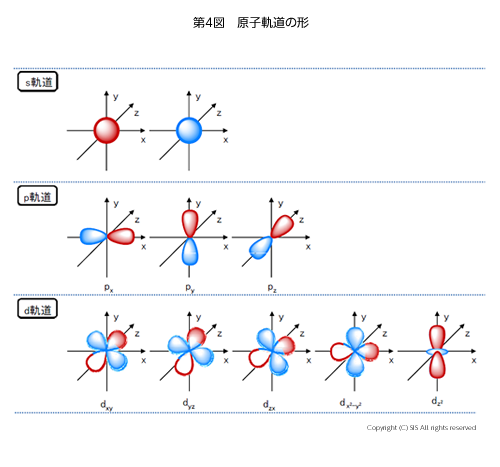
H はハミルトニアン演算子、Eは電子の運動エネルギー、Ψは電子の波動関数を表している。この方程式は、私の学生時代にはかなり哲学的に感じたものであった。いざ、学生に教える立場になり苦闘していた時に、スミス教授(テキサス・クリスチャン大学)の波動関数の解説に出会い一瞬にして霧が晴れた気がしたものである。彼は、波動関数 Ψを指数関数eaxとおき、Ψを x で微分すると ∂Ψ/∂x=aeaxで、a は定数であるからエネルギー E と置換えられ、また∂Ψ/∂xは x で微分するという演算子と考えられるのである。これでシュレジンガーの波動方程式の意味が、ずっと身近に感じられたものであった。この波動方程式を、変分法を用いて解き極座標で表示すると、第 4 図に示すような丸い形の 1 つの s 軌道、亜鈴形の 3 つの p 軌道、軸性亜鈴形やフラフープのような帯を持つ亜鈴形や軸間亜鈴形の 5 つの d 軌道が表され、そこに電子が波動運動をしながら存在していると考えたのだ。赤、青は電子波の位相の違いを表している。
余談になるが、東京駒込にあった理研には、長岡半太郎、小型サイクロトロンの建設で有名な核物理学者の仁科芳雄、また、彼の下に集まった湯川秀樹や朝永振一郎が在籍し、戦後、埼玉県和光市に移転しても 113番の新元素(ニホニウム)の合成等、理研は世界の核物理学の先端を走っている。一方、ヨーロッパにはウイーン旧市街の北に位置して市庁舎があり、その隣に古色蒼然としたウイーン大学がある。この玄関ロビーにはシュレジンガーとアインシュタイン教授の肖像写真が架かっており、当時、量子論を闘わせ合った物理学者達の熱気を感じることが出来る。それにもまして驚くのは、かつてアインシュタインを日本に招いた人が、哲学者である西田幾太郎であったことである。学生時代に、量子論が哲学的と感じたのはまんざらでもなかった気がするのである。
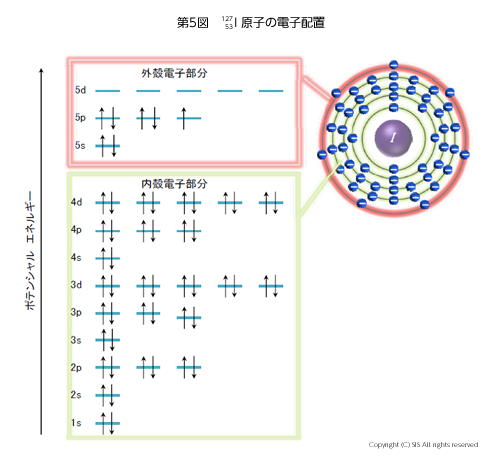
さて、ヨウ素原子 (12753I) は 53 個の電子を持ち、それらは第 5 図のように原子核の周りに存在している。原子核に近くエネルギーの一番低い 1s 軌道から二番目に高い 5s 軌道までに 48 個の電子が分布し、3 つの 5p 軌道に 5 個の電子が存在している。各軌道はパウリの禁制に従い、電子スピンを逆にして 2 個の電子が占めている。ヨウ素原子の反応性をみる場合に、53 個全電子の運動式をシュレジンガー方程式に入れて計算するのは大変であるので、便宜的に、化学反応に最も関与するであろう 5s と 5p 軌道(フロンティア軌道)の電子のみをヨウ素電子の原子軌道として計算する。
次に、ヨウ素原子 2 個からなるヨウ素分子は、それぞれのヨウ素原子のフロンティア軌道 (X1とX2) の 14 個の電子が分子全体に存在することになり、新たな分子軌道 (Φ) を形成する。この分子軌道は各原子軌道を直線的に足し合せる LCAO 法により
Φ = C1χ1 + C2χ2
と表される。
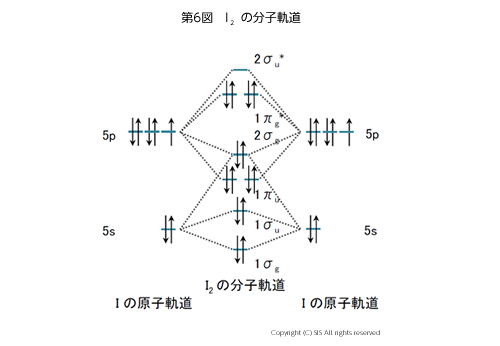
係数 C1とC2 は 分子軌道に関与する原子軌道 χ1 とχ2 の割合を表す。その計算した結果を第 6 図に示す。ヨウ素原子は、5p 軌道にエネルギー準位の近い5個の 5d 軌道が結合に使えるので、3, 5, 7, 8 配位と超原子価化合物が存在可能となる(第 7 図)。これについては詳しく後で述べたい。
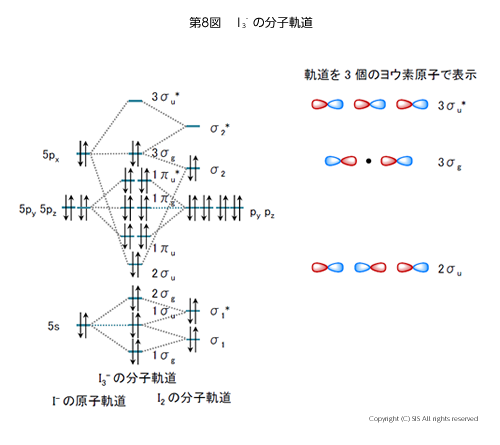
ヨウ素水溶液で存在するポリヨウ素イオン(I3–)は、ヨウ素分子の分子軌道とヨウ素イオンの原子軌道から出来るとして同様に処理し、その分子軌道を第8図に示した。
別の見方から軸方向分子軌道を考えると、2 個のヨウ素分子の2σu3σg3σu* と1個のヨウ素の5px との重なりと近似され、この結合は3中心4電子構造といっている。
このように一番反応に関与する電子のみを分子軌道の計算に採り入れたのがヒュッケルで、化学反応の考察に量子化学を容易に利用出来るようにした功績は大きい。
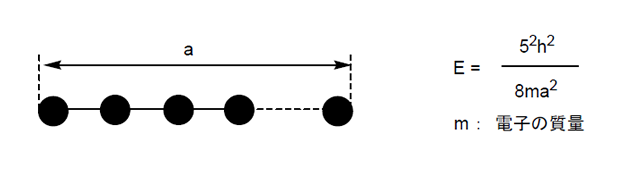
ヨウ素分子では、2σg軌道の電子を2σu*軌道に励起するには、そのエネルギー差に相当する波長の光を吸収する必要がある。それは次の式(E = hν = hc/λ)から求められる。Eは光のエネルギー、hはプランク定数、νは光の振動数、λは光の波長、cは光速度を表す。計算によると、ヨウ素分子のλは409 nmになる。我々の目は、可視光領域からこの波長の光を除いた反射光をみて赤紫色と感じている。I3–の場合は、2σgと2σu*のエネルギー差から397nmの光を吸収する。もっと長いポリヨウ素になると、量子化学計算から導出された下式から、分子の長さ(a)の二乗に反比例して励起エネルギー(E)は減少するので、吸収光の波長は長波長側にずれていくことになる。
実際に、安定に存在するポリヨウ素イオンは次式で表される。
8)人工偏光板はどのような構造になっているか
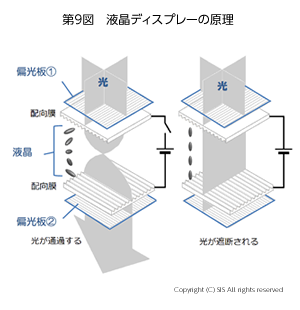
ポリヨウ素イオンの工業的利用として偏光フィルムがある。ところで、一定の平面で振動する光を平面偏光という。19世紀初めに、2個の方解石を貼り合せた、いわゆる、ニコルプリズムで、平面偏光が得られることが発見された。後に、アメリカのポラロイド社は、方解石、ヨウ素、そしてヘラパタイト(酸性硫酸キニーネと酸性過ヨウ化物)をアセチルセルロース膜に結晶軸を揃えて固定する方法で、商品名ポーラロイドの人工偏光板を市販した。これにより、高価なニコルプリズムに代わり、大型偏光フィルムが廉価に手にすることが可能となった。偏光フィルムは、偏光フィルターをはじめ多くの利用があるが、近年、需要が増加している液晶ディスプレ-にこれが必要なのである。そこで液晶に如何に利用されているか、その原理を調べよう(第9図)。
液晶ディスプレ-には、2 枚の偏光フィルムが偏光子と検光子に使用されている。この間に、電極板でサンドイッチされた液晶分子が入っている。液晶分子は電気的に分極した棒状の分子なので、いわゆる棒状磁性体と見なせる。ここに使用されている電極板の表面は、揃った分子配向の界面活性剤や一定の形状の蒸着酸化物薄膜や微細な溝等で調製されている。この電極板の間に液晶分子が入ると、図9の左のように、90°回転した状態(ツイストネマチック、TN)に液晶分子が並ぶ。ここで少し説明を加えると、液晶は常温で結晶に、高温で液体になる物性を持っている。その中間の状態が液晶といわれる状態で、その中でも結晶に近く比較的整然と分子の並んだスメチック状態 (S) と、完全にバラバラなネマチック状態 (N) がある。液晶ディスプレーに使われるのは、電極間で 90°回転しているTN状態なのである。第 9 図の左に示すように、これに偏光子を通過した平面偏光が入射すると、ファラデーの磁場効果により液晶分子に沿って 平面偏光の振動面が変わる。すると、偏光子に対して光学軸を直交するように置かれた検光子を平面偏光が通過できるようになる。次に、電極間に電気を通すと、図9の右のように、液晶分子は両極間に垂直に並び入射偏光面を変えることができず、平面偏光は検光子を通過できなくなる。即ち、電流をオン、オフすることで光をオフ、オンすることが可能となる。これがディスプレーへの作動機構である。
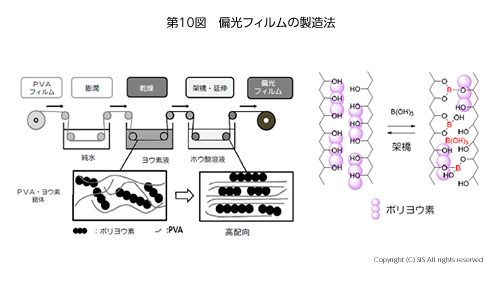
それでは、液晶ディスプレーに使われている偏光フィルムはどのような微細構造をとっているのだろうか。膨潤されたポリビニルアルコール (PVA) フィルムをヨウ素・ヨウ化カリウム水溶液に浸し、次に、ホウ酸処理後 3-5 倍に圧延し乾燥する。すると、延伸方向に並んだ PVA 分子鎖間のポリヨウ素イオン (I3–, I5–) がきれいに並んだ偏光フィルムが作成される。この膜の光学軸は延伸方向と直角になっている。この膜を詳細に見てみると、重合度 2400 程度の PVA の結晶部分の表面と非結晶部分の PVA 分子鎖の間にポリヨウ素イオンがサンドイッチ状に挟まれていて、その両端がホウ酸テトラマーで閉じられ固定された構造をとっていることがわかる(第10図)。
従って、自然光が通過すると光学軸に振動面を持つ平面偏光が得られるのである。
9)超原子価ヨウ素化合物とはどんなものか
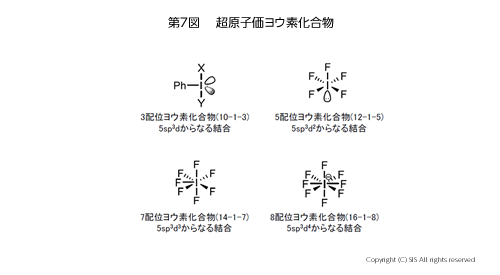
ハロゲン元素の中でも、フッ素を除く塩素、臭素、ヨウ素は遷移金属と同じように電子が利用可能な d 軌道を有しているので、超原子価をとり得る。最近、落合教授(徳島大学)はこれらの 3 配位ハロゲンイリド化合物の単離に成功し、それらの安定性を I > Br > Cl の順であるとした。ヨウ素は 3 と 5 配位化合物に加え、さらに 7 と 8 配位の超原子価化合物 (IF7, IF8–) も存在する。
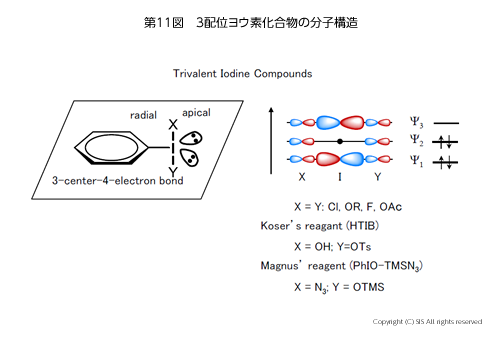
まず、3 配位のヨウ素化合物からその分子構造と反応を見てみよう。構造は第 11図に示したように、ベンゼン環の炭素とヨウ素およびその 2 つの孤立電子対が sp2 混成軌道をとり平面状にそれぞれ内角 120° で存在する。その平面に対して垂直に置換基 X と Y があり、X 線構造解析からその結合距離(I-X及び I-Y) は平面内の C-I の結合距離(ラディアル結合距離)よりかなり長くなっており、弱い結合である(アピカル結合)。このアピカル結合 (X-I-Y) は 3 中心 4 電子結合と言われ、分子軌道の計算から電子は結合軌道 Ψ1、非結合軌道 Ψ2 にそれぞれ 2 個ずつ存在し、空の 1 つの反結合軌道 Ψ3 から成り立っている。
歴史的には、1886 年ビルゲロットがヨードベンゼン (PhI) を塩素化してヨードベンゼンジクロリド(PhICl2) を黄色結晶として得たのが最初で、その後、ヨードベンゼンジアセテート [PhI(OAc)2]、Koser 試薬 (HTIB)、Magnus 試薬 (PhIO-TMSN3) が合成された(第 11 図)。
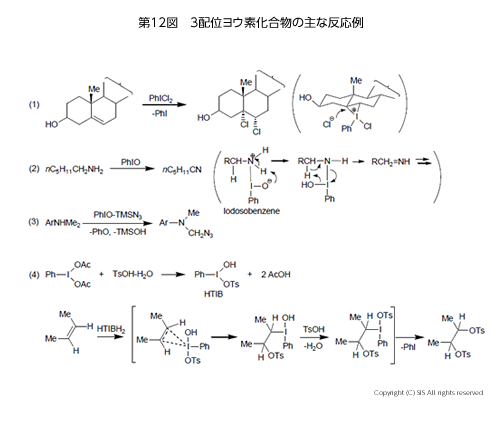
これらの主な反応例は第 12 図にまとめてある。即ち、(1) ヨードベンゼニウムクロリド(PhI+Cl) がアルケンに求電子付加、塩素イオンが置換後、還元的脱離でヨードベンゼンを放出する。(2) ポリマー状のヨードソベンゼン (PhIO) がアミンをニトリルまで酸化する。(3) Magnus 試薬がメチル基をアジ化する。(4) PhI(OAc)2 にp-トルエンスルホン酸水和物 (TsOH・H2O) を反応させ Koser 試薬をつくり、これをアルケンに反応させるとトシルオキシ基 (TsO) が隣接するジトシレートが合成できる。
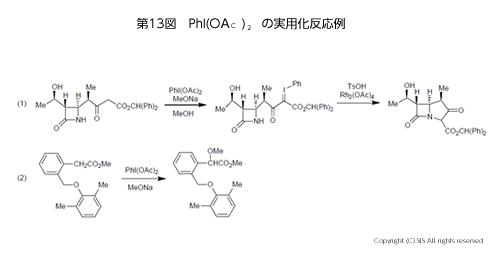
中でも、ヨウ化ベンゼンから容易に合成出来、しかも、比較的安全に取り扱うことが可能な PhI(OAc)2 は工業的にも有用な試剤である。主な反応例を第 13 図に示す。(1) β-ケトカルボン酸エステルの α-位を酸化し安定なヨウ素イリドを合成後、ロジウムアセテート [Rh2(OAc)4] で酸化すると、α- 位炭素のカルベンを生じ、β-ラクタム環のNH に付加閉環する。(2) フェニル酢酸エステルのベンジル位を PhI(OAc)2 でアセテートに酸化後、アルコラートに変換している。
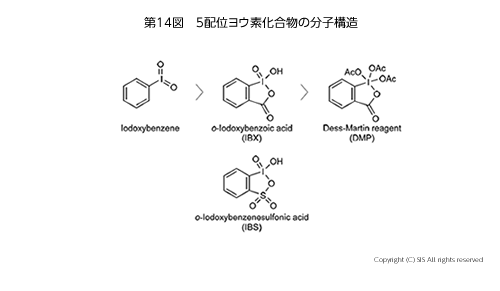
5 配位ヨウ素化合物としては、o-ヨードオキシ安息香酸 (IBX) や Dess-Martin 試薬 (DMP) があり、それぞれ特徴ある酸化剤として使用されているが、爆発性があるため使用には十分に注意を払わねばならない。そこで、最近、o-ヨードベンゼンスルホン酸ナトリウム塩から OXONE で酸化して得られる o-ヨードキシベンゼンスルホン酸 (IBS) を単離せずに使用する方法が考案されている (第 14 図)。
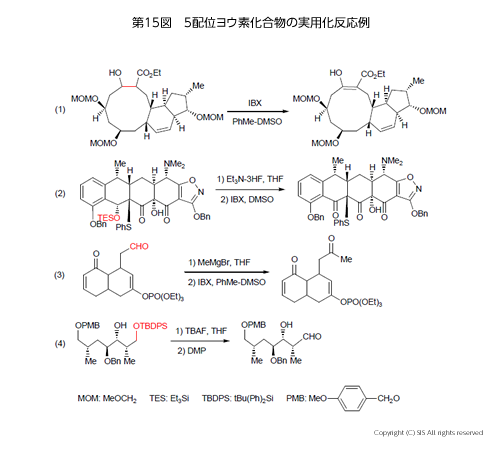
実用化反応例を第 15 図にまとめた。即ち、(1) IBX はシクロデカン環の水酸基を損なわず選択的に環を酸化している。(2) シリル基で保護された水酸基を脱保護 (TESO →HO) した後、もう1 個の水酸基を損なわず選択的にIBXで酸化している。(3) グリニャール反応でアルデヒド基を2級アルコールにした後IBXで酸化している。(4) 選択的脱保護化の後1級アルコールをDMPで酸化しアルデヒドで止めている。
7 配位ヨウ素化合物としては、古くから知られている過ヨウ素酸ナトリウム (NaIO4) がある。これはオスミウム酸(OsO4) と同じような酸化様式で反応がすすむ。
10)電導性ポリマーではヨウ素はどんな働きをしているか
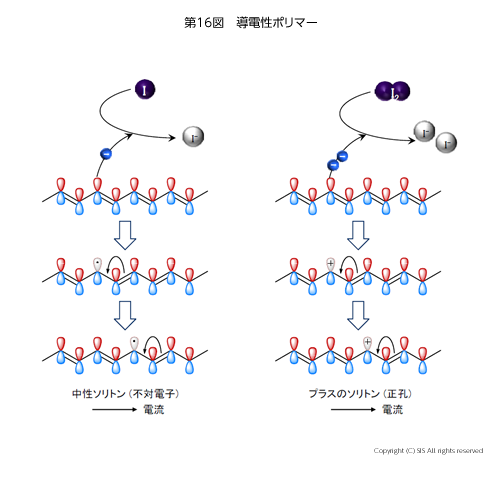
白川教授(筑波大学)の電導性ポリマーの仕事を見てみよう。当時、ポリアセチレンはアセチレンモノマーの重合により繊維状にしか合成出来なかった。しかし、学生が過剰の触媒を使用するという調合ミスから、ポリアセチレンフィルムの合成に成功したのである。これ自体は半導体の性質を示すが、米国のマクダィアミット教授(ペンシルベニア大学)の示唆によりヨウ素をドープしたところ、金属の性質(電導性 10-5 Scm-1)をとることが分かった。この電導機構はソリトン効果の理論で説明出来、生物の神経伝達機構と同じであるとした、もう一人の共同研究者であるヒーガー教授(カルフォルニア大学)の 3 人に 2000 年ノーベル化学賞が与えられた。
では、ポリアセチレンの高分子構造はどうなっているのだろうか。この高分子を構成する原子は炭素 (126C)と水素 (11H) だけである。炭素原子は 6 個の電子を持ちその電子配置は (1s)2(2s)2(2p)2 である。つまり、1 個の 1s 軌道に 2 個、1 個の 2s 軌道に 2 個、3 個の 2p 軌道に 2 個の電子を原子核の周りに持っている。ポーリングは、1 個の 2s 軌道と 2 個の 2p 軌道から 3 個の 2sp2 という混成軌道が出来ると考えた。そしてそれぞれに 1 個ずつ電子が入り、残りの 1 個の電子が 2p 軌道に入ってくる。これは第 16 図に示すように、共役 2 重結合を持つ 2 次元に広がった炭素-水素原子平面骨格からなり、その平面骨格に 1 個の電子を有する亜鈴型の 2p 軌道が垂直に連なる構造なのである。これにヨウ素がドープすると、その酸化作用で 1 電子および 2 電子酸化が起こり、それぞれ中性ソリトンおよびプラスのソリトンが出来上がり、矢印のような電子移動が可能となる。このドープされたヨウ素は X 線吸収スペクトル (XAFS) とメスバウアースペクトルから、I3– と I5– のポリヨウ素イオンの形で存在していると考えられている。
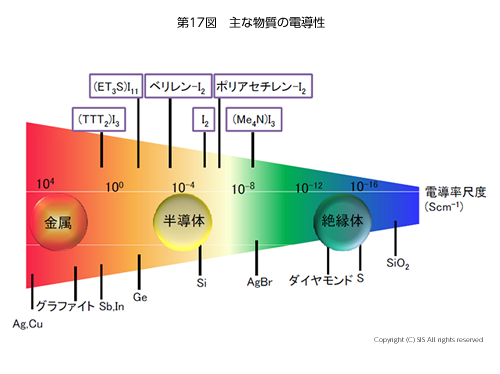
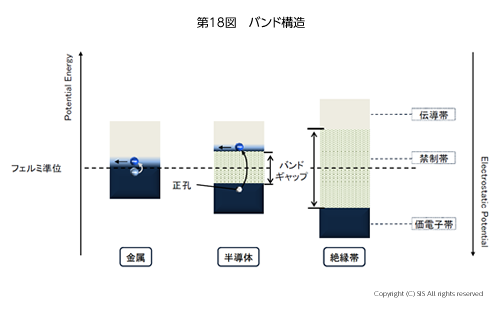
ここで、金属と半導体の知識をまとめてみたい。主な物質の電導性を電導率 (Scm-1) の尺度で第 17 図に示した。金属と半導体の違いは、固体化学のバンド理論(第 18 図)を借りると、金属は伝導帯に常時電子が存在するが、半導体は熱や光で価電子帯を励起して初めて伝導帯に電子を持てるようになる。一方、絶縁体は熱や光で価電子帯から伝導帯のエネルギー差が大きく励起できない。さて、温度が上がると、金属の場合、最外殻の自由な電子を除いた原子核を含む残部を原子コアと呼ぶと、原子コア間の振動増加により自由電子の流れが阻害される。即ち、電気抵抗の増加が認められることになる。一方、半導体の場合は伝導帯への励起電子の増加で電流がより流れ易くなる。
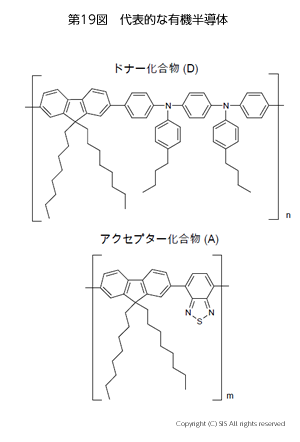
次に、光をあてて電気を発生させる半導体の話をしたい。第 19 図に代表的な有機半導体を示した。
ドナー化合物 (D) の半導体膜に太陽光があたると、バンド理論に従って D の価電子帯にある HOMO 電子が伝導帯の LUMO に励起されてプラス極に電子が流れる。残った価電子帯の HOMO の正孔にマイナス極から電子が移る。
この HOMO と LUMO のエネルギー差は、ケイ素 (Si) が 1 eV、ポリアセチレンのトランス型が 1.4 eV でシス型が 2 eV、そして硫化カドミウム (CdS) が 2.5 eV であり、この順で電気が生じ難くなる。
なお、効率良い発電には、ドナー (D) 型膜とアダプター (A) 型膜を 35 : 65 の割合で接続した混合構造型が良いことが報告されている。
11)有機金属はどんな構造をしているか
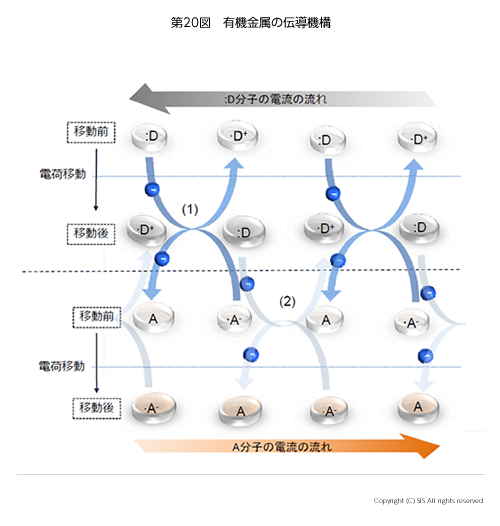
1950 年代、井口教授(東京大学)はトリフェニレンと臭素の錯体が電流を流すことを発見し、これが有機金属の最初とされている。この錯体構造は 18個のp 電子を持つトリフェニレンの一番高いエネルギー準位にある 1 個の電子が臭素の 4p 軌道に移ることにより生じた電荷移動錯体である。この場合電子を与えたトリフェニレンがドナー (D) といい、電子を受取った臭素はアクセプター (A) という。従って、この錯体を記号で表示すると [・D+ ・A–] になる。
第20 図から分るように、・D+ と D および ・A– と A とが交互に重なると矢印の方向に電子の移動が可能となる。この有機金属の電導性を上げるためには、第一に電子を与え易いドナー化合物と受取り易いアクセプター化合物との組合せ選定がある。次に、これらを結晶内に如何に上手く意図的に配列させるかと云う問題がある。ここにもヨウ素が登場する。例えば、ドナー化合物にヨウ素官能基をつけ、一方、アクセプター化合物に n 電子を持つ窒素や酸素官能基をつけたものを組合せると、C-Iの空の反結合軌道 (σ*) に n 電子が引き寄せられた、いわゆる、ハロゲン結合 (~S, N, O ・・・・I, Br, Cl~) が出来て期待する錯体 [・D+ ・A–] の配列が得られる。
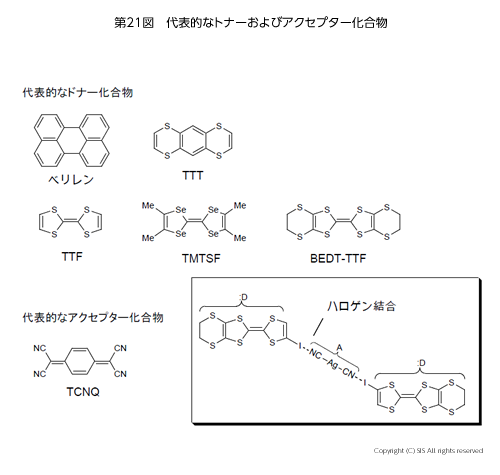
第 21 図に代表的なドナー化合物とアクセプター化合物、さらに今久保教授(長岡科学技術大学)のハロゲン結合を利用した錯体合成例 (囲み) を示した。
また、2,3,5,6-tetraiodoquinone (iodanil) や hexaiodobenzene は加圧下 (35 GPa)、低温 (~2K) で超電導性を示す。
有機ゼオライトである tris(o-phenylenedioxy)cyclotriphosphazene の分子性結晶の細孔にヨウ素を包接すると、ヨウ素分子のナノワイヤーが形成され、それは 10-4-10-6 Scm-1 の電導性を持つことが分かった。
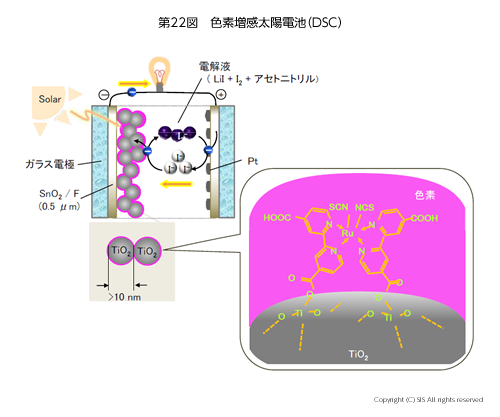
12)色素増感太陽電池の構造はどうなっているのか
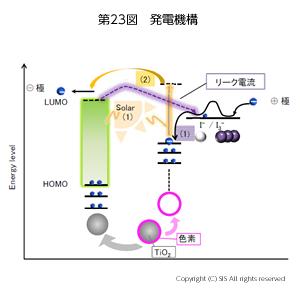
太陽光から無機 EL 材料を利用して電気を得る方法がある。これは、無機半導体の酸化チタン (TiO2) を発電材料として使用しているが、TiO2 の HOMO と LUMO の励起エネルギーは太陽光の紫外線に相当するようにかなり大きい。より多くのエネルギーを利用するには、太陽光の約 45% を占める可視光線 (420~700 nm) を利用する必要がある。従って、増感剤である有機金属化合物を用いる方法が採用される。代表的な装置を第22図に示した。
太陽光の吸収面積を増やすために球状の TiO2 を用い、色素にはカルボキシル基を導入して TiO2 にエステル結合で強固に固定している。この色素増感剤を使用すると、太陽光の 90% のエネルギーが利用可能となる。この電解液にポリヨウ素イオンが登場する。電解液中の I–/I3– の酸化還元系で効率良く電子を運ぶことができ、Fe -Co 系の電解液よりリーク電流が少ないと云う利点がある。第23図に発電機構を分り易く示した。TiO2の HOMO 電子の励起以外に色素増感剤でより長波長の光まで吸収可能であることがわかると思う。
ここに流れる電流(I)は次の式で表される。
電流 (I) を大きくするためには、2極間距離を短く、溶液粘度を下げて I3– の拡散定数を大きくする。
また、I3– の溶解性を上げて濃度を大きくすることである。
最近、宮坂教授(桐蔭横浜大学)はペロブスカイト色素と云う (PbI6)– からなる八面体無機ホスト化合物 2 個の層間にメチルアミンのヨウ化水素酸塩 (CH3NH3+I–) が挿入された高電導性固体を合成した。これは従来の液型電解液と比較して、太陽エネルギーの変換効率が20%に改善された。太陽電池は、今や新しい時代に入った感がある。この高伝導性固体の出現は小型で高電気量が可能なリチウムイオン電池にも利用されると思われる。
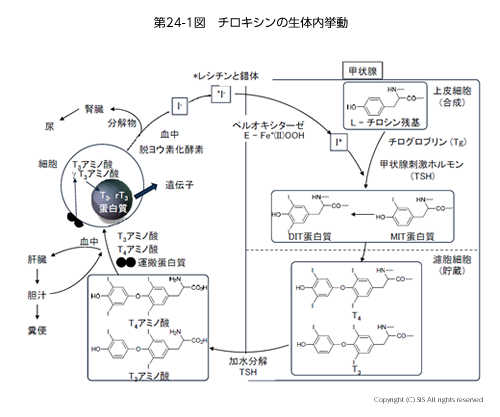
13)甲状腺ホルモンは体内で如何に働いているのか
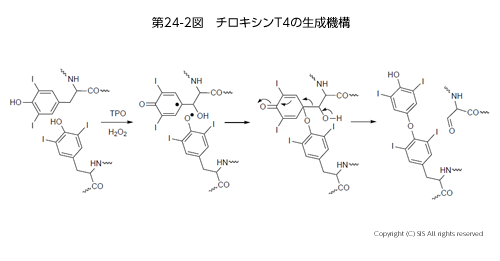
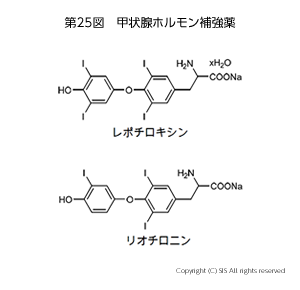
生体内の作用機作サイクルから薬が誕生した例として甲状腺ホルモン(チロキシン)がある。血中のヨウ素イオンは、甲状腺にある濾胞細胞の上皮部分の細胞にレシチンと結合して入り、そこでペルオキシダーゼという含鉄酸化酵素 (E-Fe+(II)OOH) でヨウ素カチオンに酸化される。次に、チロキシンの前駆体であるチログロブリンをヨウ素化して モノヨードチロシン (MIT) やジヨードチロシン (DIT) タンパク質に変換する。これらのタンパク質が濾胞細胞内でチオペルオキシダーゼと過酸化水素で酸化カップリングされ、チロキシン T4、T3 として貯蔵される。必要に応じ、酵素によりタンパク部分が加水分解され、T4 あるいは T3 アミノ酸として血中に運ばれ目標とする細胞に入る。そこでは T4アミノ酸は γT3 アミノ酸に変わるが、T3 アミノ酸のみが酵素の遺伝子合成に有効に関与できる。ホルモンとして働いた後は、脱ヨウ素化酵素の作用でヨウ素イオンに分解され再利用されるか、過剰分は分解廃棄物と一緒に腎臓より排泄される(第 24 図)。
この作用機作から、商品名でレポチロキシンやリオチロニンが甲状腺ホルモン補強剤として登場した(第 25 図)。
14)ヨウ素は消毒、殺菌、殺虫剤として如何に作用しているのか
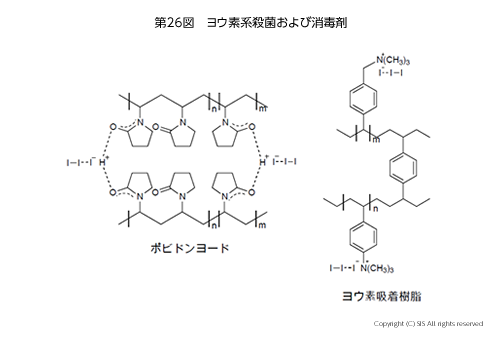
含ヨウ素殺菌剤でうがい薬や手や傷の消毒剤に広く使われている例を第 26 図に示した。
ポピドンヨード(代表ブランド:イソジン)は、ヨウ素の以下のような酸化作用を利用したものである。
発生したヨウ素カチオンは水溶液では H2OI+ の形で存在して、生体内のタンパク質のアミノ酸残基であるシステインを酸化したり、チロシンやヒスチジンをヨウ素化することでタンパク質を変質させる。黄色ブドウ球菌に起因するアトピー性皮膚炎にポピドンヨードが効果的であるとの治療報告がある。また、殺菌性樹脂もあり、ウイルスや細菌をヨウ素で殺菌する。
15)医療に使われるヨウ素化合物にどんなものがあるか
静脈→腎臓→排泄の尿プロセスの診断には、放射性ヨウ素同位体 (123I) が使われる。
これは放射エネルギーが弱く (γ:0.159 MeV) 寿命が短いからである(半減期 13.27 時間)。
甲状腺癌の治療には、放射エネルギーの大きいβ崩壊するNa131I が使われている。(β: 0.606 MeV,γ: 0.364 MeV)。
また、最新のポジトロン放射断層撮影 (PET) では、半減期 4.2 日の放射性ヨウ素同位体(124I) を組込んだヌクレオシドを注射投入し、人体の輪切り断層撮影を可能とした。
これは、124I から放出されるポジトロン (e+) が周囲の電子 (e–) と衝突し生じる γ線をコンピュータ画像で捉えるもので、例えば、癌の部位に多くのヌクオシドが集まるので、明確な診断が出来るのだ。
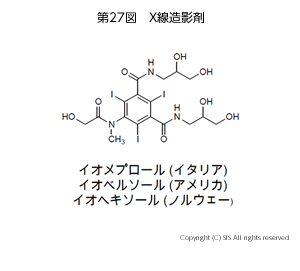
血管及び各種臓器の診断に X 線造影剤が用いられている。
これには、X線の吸収能が良く、安全かつ安定な化合物としてヨウ化ベンゼン誘導体が開発された。初期は水溶性を上げるべくカルボン酸塩が用いられたが、通常の血管注入でも 60-70% 水溶液で 100 mL とかなりの量を使用するので、急激な浸透圧の上昇により激痛を伴い副作用が大きい。これを除くために現在では、糖やアミドのような親水性官能基を持つ非イオン性造影剤が用いられている(第 27 図)。
また、大豆レシチンとヨウ素を結合させたヨウレシチンは、甲状腺機能低下症、網膜炎、喘息気管支炎の治療に効果がある。ヨウ素成分の多い海藻とヨウ素酸カルシウム[Ca(IO3)2]を鶏の飼料として与え、得られたヨード卵は脂質及び糖代謝改善作用、炎症やアレルギーの抑制、乳がん予防、老化防止の効果があるとされている。さらに、ヨウ素を含む医薬品として抗悪性腫瘍薬や排尿障害治療薬が知られている。
余談として、トルストイの代表作、『アンナカレーニナ』には、肺結核にかかった人がヨウ素吸引をする場面が出て来る。当時は、ヨウ素で病原菌殺菌をしていたのである。
16)ヨウ素の吸着が物質にどんな影響を与えるか
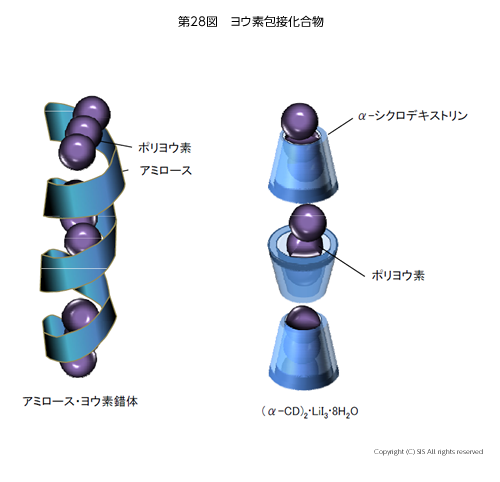
第28図に示すように、ヨウ素デンプン反応で生じるアミロース・ヨウ素錯体は、1,4 結合の α-(+)-グルコース単位からなる α-ヘリックス型アミロースの中に、ポリヨウ素が包接された構造を持っている。
現在、吸収スペクトル、円偏光スペクトル、メスバウアー測定結果より、ポリヨウ素は I3→← I5– の平衡イオン状態であると考えられている。
α-シクロデキストリン (α-CD) とヨウ化リチウムそしてヨウ化カドミウムの結晶は、X 線構造解析からポリヨウ素は I5– 単位の包接構造体である(第 28 図)。
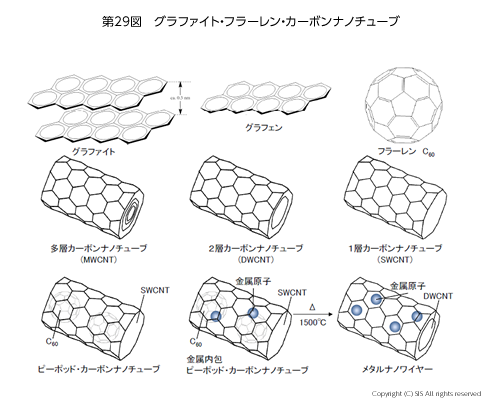
第 29 図に示すように、炭素の同素体であるグラファイトは縮合ベンゼンの平面(グラフェン)の多重積層構造体である。この電気伝導性は、平面の垂直方向を 1 とすると平面方向のそれはおよそ 1000 倍である。現在、グラフェンはグラファイトからセロテープで剥がし取ることで入手できる。さらに、化学蒸着法 (CVD) で銅板上に メタンガス (CH4) を熱分解することで大面積のグラフェンシートを調製することが可能となった。そして、グラフェン平面上の電子速度はグラファイトの平面方向のそれよりかなり速いことも分かった。この速度は光速度の 1/300 にも相当し、もちろん金属中の電子速度より速い。そこで物理学では、金属中の電子を準粒子、グラフェン面上の電子をデイラック粒子、と区別している。準粒子は量子力学で扱う不完全なトンネル効果を示す粒子であるが、一方、完全なトンネル効果を示すデイラック粒子は、新たに登場した量子電子力学で取り扱われ、量子コンピュータへの利用が今検討されている。
近年、炭素同素体としてグラファイト電極間でのアーク放電により得られた煤から、クロトー教授(サッセクス大学)、カール教授(ライス大学)、スモーリー教授(ライス大学)によりフラーレン C60 が発見された。その後、C70, C76, C78, C80 が続々と見出された。一方、飯島教授(名城大学)はアーク放電の陰極堆積物の中から、カーボンナノチューブ (CNT) やカーボンナノホルンを発見したのである。CNT には入り子形の多層構造体 (MWCNT) と 2 層構造体 (DWCNT)、そして 1 層構造体 (SWCNT) とがある。標準形の SWCNT は内径 1.4 nm 程度なので、真空中でおよそ直径 1 nm のフラーレン C60 と処理すると、C60 を内包したピーポッド・カーボンナノチューブ (ピーポッド CNT) が合成できる。C60 の中に金属原子を入れたピーポッド CNT を高温で処理すると、C60 が昇華して SWCNT が DWCNT に変化して、DWCNT のメタルナノワイヤーが出来る。
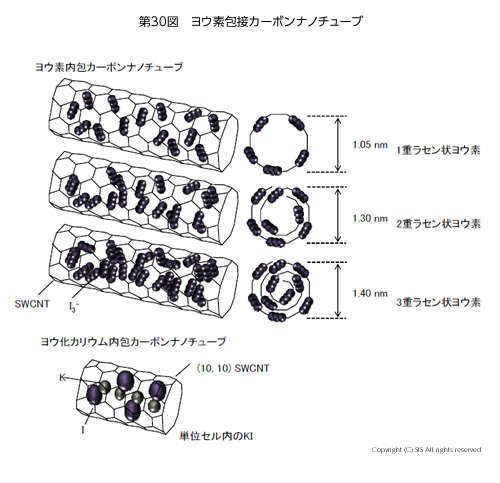
第 30 図には、CNT 類とヨウ素吸着体の例を示した。束状の CNT にヨウ素を吸着させると、CNT内部ではなく、束の隙間にヨウ素が挿入された CNT 類が得られ、これは電気伝導性の向上に寄与することが分かった。
グラフェンを巻いたものが SWCNT であるので、その巻く角度により 3 つのキィラリティが生じる。即ち、金属性の (n,n) SWCNT、1/3 金属性・2/3 半導体性を持つ (n,0) SWCNT そして半導体性を持つ (n,m) SWCNT である。
次に、内径の異なる SWCNT にヨウ素を内包させると、1 重ラセン状ポリヨウ素、2 重ラセン状ポリヨウ素、そして3 重ラセン状ポリヨウ素を含む SWCNT が出来上がることが分かった。さらに、(10,10) SWCNT に ヨウ化カリウム (KI) を内包させると、単位セルに 4 個の KI 分子が詰まり、4 個の K 電子から 1 個の電子が SWCNT 壁に移行し、残り 3 個の電子は 4 個の I 原子に移行している錯体が得られた。これら材料が示す物性はどのようであるか興味あるところである。
17)有機ヨウ素化合物はどのように利用されているか
ヨウ素を筆頭とするハロゲン化アリール(ArX)及びアルケニル化合物は、直接結合させることで、電子材料、医薬品、光学材料等の合成に利用されている。これらハロゲン化合物の結合手段として、銅 (Cu) を触媒とする Ullman 反応は昔から知られているが、現在では、異なるハロゲン化合物に対してパラジウム (Pd) を触媒とする穏和な反応が主流である。その中でもとりわけ、取扱い易さや安全性の点から、鈴木・宮浦クロスカップリングは工業的に注目されている。そこで、この反応を少し詳しく述べてみたい。
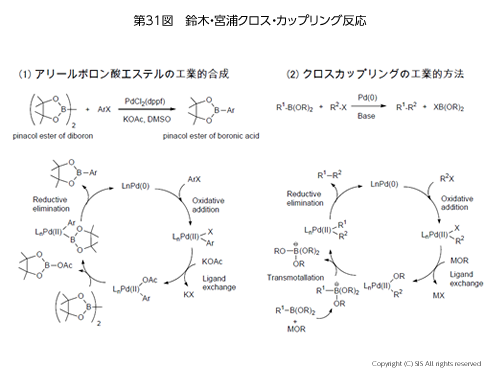
この反応の概略は第 31 図にまとめてある。式 (1) は、原料となるアリールボロン酸ピナコールエステルの合成で、塩基 (AcOK) 存在下、ハロゲン化アリール (ArX)を Pd を触媒として反応させる。即ち、最初に Pd にハロゲン化アリールが酸化的付加をし、AcOKでリガンド交換後、再びジボロン酸ピナコールエステルでリガンド交換、次に還元的脱離が起こり、アリールボロン酸ピナコールエステルの生成と同時に、再生された Pd を触媒として再利用するのである。式 (2) は、得られたアリールボロン酸ピナコールエステルとハロゲン化アリールを塩基存在下、Pd を触媒としてカップリングする方法である。反応機構は式 (1) と同じである。これらに使用されるハロゲン化アリールのハロゲンは主に臭素とヨウ素であり、その反応性は I> Br の順である。
この反応は、工業材料および医薬品の製造に非常に重要になってきており、特に北教授(大阪大学)の Pd の代わりに超原子価ヨウ素化合物 [反応例では、PhI(OTs)(OH)] を触媒とするクロスカップリング反応は注目に値する。周期表の第 5 周期の金属と非金属が類似反応を起こした最初の例であり、有機反応では先駆け的研究である。
高価な Pd 触媒の代替とし、単体ヨウ素触媒や鉄系触媒の利用、さらには環境にやさしい水系反応や高価なアリールボロン酸やエステルの代わりにアリールグリニャール化合物やアリール化合物の水素の活性化によるクロスカップリング法の開発など、省資源および環境にやさしい反応の検討が進められている。
18)ポリマー合成にヨウ素はどう関わっているか
ポリマーを合成するには、原料となるモノマーを重合開始剤から生ずるカチオン、アニオン、及びラジカル分子種を利用して重合を行う。この際、重合されたポリマーの分子量を出来る限り揃えると高品質のポリマーとなる。この方法として、ラジカル・リビング重合法が知られており、この反応にヨウ素が利用された例を説明する。即ち、鉄触媒にヨウ素を添加すると、一部ヨウ化鉄触媒となり、これが生成するラジカル・ポリマー中間体の濃度をヨウ素交換により一定に保ち、分子量の揃ったポリマーが合成される。
また、フォトポリマーへの利用がある。半導体分野で使用されている微細加工レジスト材料、プリント配線基板、液晶カラーフィルター、情報記録材料等で、重合開始剤にジアリールヨードニウム塩が使われる。これは、光により分解されて生じる酸及びラジカル分子をポリマー重合に用いているのである。
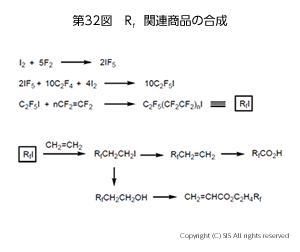
工業的利用として、含フッ素化学薬品、及び機能性フッ素系ポリマー合成例を第 32 図にまとめた。五フッ化ヨウ素 (IF5) からテロメリゼーションにより C2F5(CF2CF2)nI (RfI) を合成し、エチレンに挿入することにより、多様な含フッ素化学薬品を製造している。また、テトラフルオロエチレンとヨウ素から得られるペルフルオロ-1,4-ジヨードブタンを原料として、機能性フッ素系ポリマーの合成が行われている。
また、半導体の加工にもヨウ化物が登場する。従来はテトラフルオロメタンやヘキサフルオロブタジエンガスが使用されてきたが、近年、集積回路の微細化とともに地球温暖化係数の小さなトリフルオロヨードメタン(CF3I) ガスを使用すると、プラズマ中の UV 強度と F ラジカル量が減少し、加工時の変質層も少なくなりシャープな微細加工が可能となった。
19)ヨウ化金属が電池の材料になる
心臓ペースメーカー用電池に、リチウム電池が用いられている。プラス極はポリビニルピリジンとヨウ素、マイナス極はリチウム金属 (Li) からなっている。即ち、マイナス極面ではLi → Li+ + e–、プラス極面ではI + e– → I– 反応が起きている。そこで生成した LiI が固体の電解質として働いている。将来のエコカーには、ニッケル電池より小型で高出力のリチウム電池の利用が大幅に増加すると思われる。
最近の研究では、硝酸銀、ヨウ化ナトリウム、そしてポリ-N-ビニル-2-ピロリドンのそれぞれの水溶液を混合するという簡単な方法で、高イオン伝導性の 10 nm のヨウ化銀(AgI) ナノ粒子が出来ると報告されており、固体型電池への利用が期待されている。この固体の電導性について、例えば、α-AgI が電気伝導度 1 Sm-1 (150 ℃) を示すのは、体面立方格子で存在する大きなヨウ素イオンの格子中に副格子を構成する銀イオンが自由に動くモデルが考えられている。
話は変わるが、ガラスにもヨウ素が働いている。普通のソーダ石灰ガラス (Na2O-CaO-SiO2) や光ファイバー用シリカガラス (SiO2) にはヨウ化リチウム、ヨウ化ナトリウム、ヨウ化銀は混ぜられないが、オキシハイドライド系ガラス (Ag2O-B2O3-Metal・I) のように、これらを含む伝導性ガラスもある。
20)ヨウ化金属が有用な有機金属試薬をつくる
代表的な有機金属試薬は何と云ってもグリニャール試薬であろう。これは、グリニャールの先生にあたるバルビエールがエーテル中、ハロゲン化アルキル (R1X)、ケトン (R2COR3) と金属マグネシウム (Mg) の混合液から相当するアルコール(R1R2R3COH) を合成したことに始まる(バルビエール反応)。この反応を詳細に調べ、グリニャールがハロゲン化アルキルと金属マグネシウムからグリニャール試薬 (R1MgX) をつくり、これにケトン類を反応させる方式を確立したのである。この反応は、例外なく殆どのハロゲン化アルキルやアリール類そしてケトン類に適用できるので、今や一番汎用性のある有機金属反応として利用されている。さて、グリニャール試薬の生成機構は、Mg が RX を 1 電子還元することから始まり、0 価の Mg が 2 価の Mg に変わる。これを、RX の酸化的付加という。この時に、X がヨウ素であると、ハロゲン元素中一番還元され易いという特性が生きてくる。この特性は、重要な有機金属試薬である有機リチウム (RLi)の調製にも重要である。
現在では、有機ハロゲン化物から殆どの有機金属化合物が合成されている。一方、ヨウ化金属そのものを反応に利用することも盛んである。カガン教授(パリ第11大学)は、ランタノイド金属であるヨウ化サマリウム (SmI2) の有機反応を展開させた。
21)新しい物理的手法でヨウ素分子を見る
ヨウ素分子の振動吸収帯がピコ秒 (10-13 s)、フェムト秒 (10-15 s) の波長であるので、高速レーザーを用いたヨウ素分子の状態の観察が可能である。逆に、ヨウ素分子の吸収スペクトルからレーザー光の発振波長を同定する利用もある。現在では、アト秒 (10-18 s) レーザー光の利用からヨウ素分子の電子の偏りまで観察できるようになっている。
ヨウ素を含む物質が単結晶で得られれば、X 線回折を利用して構造決定が可能であるが、非晶質の場合は X 線吸収スペクトルを利用して構造を決定する。これは固体のような多原子系では、内核電子の励起により生じる電子の干渉効果で吸収スペクトルに変化が認められるのである。即ち、内核吸収の立ち上がりから 50 eV 程までの大きな変化 (X-ray Absorption Near Edge Structure: XANES) とそれから 500 eV 程の変化 (Extended X-ray Absorption Near Edge Structure: EXAFS)を調べ、構造を決定する。
22)有用な天然物の合成に利用される
有機合成の中で画期的成果である以下の二つの天然物合成において、ヨウ素が重要な役割を演じている。
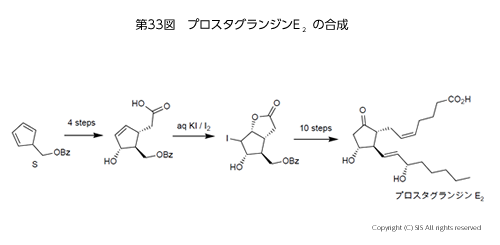
まずは、プロスタグランジン E2の合成である(第 33 図)。動物の多様な生体機能(血圧低下作用、血小板凝集作用、眼圧低下作用など)の強力な調節ホルモンとして、羊の精液中から極めて微量発見分離され構造決定されたプロスタグランジンがある。この物質の合成を出発化合物 (S) から 15 ステップでスマートに合成したのがコーリー教授(ハーバード大学)で、以下に示すヨウ素を用いるハロラクトン化反応が分子骨格の立体選択的構築に用いられている。
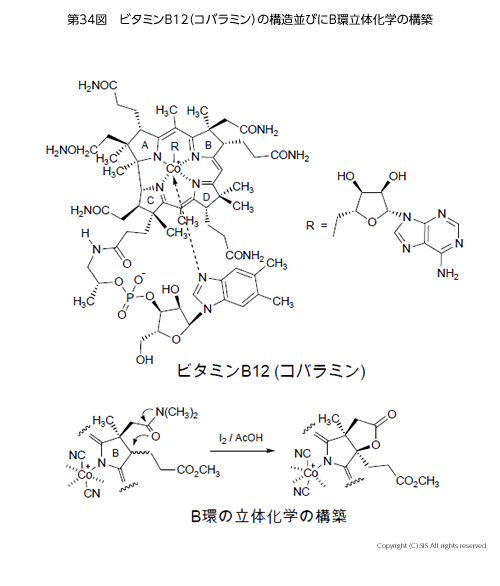
次いで、非常に複雑な構造を持つビタミン B12(コバラミン)の合成である(第 34 図)。ビタミン B12は、牛の肝臓より発見されたコバルトを含むビタミンでアミノ酸や脂質などの代謝の補酵素として働き、不足すると悪性貧血や神経障害がでる。これは微生物以外では合成されない。全合成はウッドワード教授(ハーバード大学)とエッシェンモーザー教授(スイス連邦工科大学)の共同研究の結果完成したもので、有機合成化学の最終成果とみなされた。この全合成の過程で、B 環上プロピオン酸残基の正しい立体配置の構築にヨウ素の酢酸溶液の酸化反応がうまく利用されている。
23)ヨウ素科学の新たな展開を考える
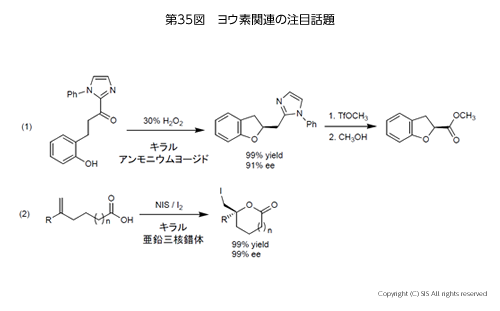
最近注目された研究のうち、ヨウ素が絡む不斉合成例を第 35図に示した。反応 (1) は石原教授(名古屋大)らのキラルなヨウ素触媒を用いた、ジヒドロカルコン誘導体からジヒドロフラン環への不斉環化反応、そして反応 (2) は荒井教授(千葉大)による不飽和カルボン酸の不斉ヨードラクトン化反応である。
24)おわりに
“ヨウ素の科学”を書いての感想を述べたい。
ある宿命を帯び宇宙に誕生したヨウ素が地球上で色々な役割を演じて来ている。ヨウ素が我々に認知され約 200年、その間の科学の進歩と共にヨウ素の役割も詳細に分って来た。ヨウ素の立場から、科学から特化した物理学、化学、そして生物学を眺めると色々な景色が見えて来る。例えば、放射性ヨウ素の短期的無害化、100 万気圧下でのヨウ素の金属化、細菌の化学合成の生物学的スピード化、チロキシン細胞内の遺伝子活性化の分子生物学的解明等々、興味の尽きることがない。
最後に、本原稿の査読、校正全てに誠心誠意ご協力頂いた4 代目ヨウ素学会会長石川勉千葉大学名誉教授に感謝致します。
参考文献
1.横山正孝 監修 “ヨウ素化合物の機能と応用”;“ヨウ素の化学と最新応用技術” シーエムシー出版、2005 年;2011 年.
2.FIU Lett., No. 1 (2001)~ No.8 (2007).
3.SIS Lett., No. 9 (2008)~ No.19(2018).
4.FIU Report, No. 1 (1998)~ No. 9 (2006).
5.SIS Report, No. 10 (2007)~ No. 20 (2017).
謝辞
今般の改版に向け多大の尽力を頂いたヨウ素学会特別会員の横山正孝氏とヨウ素学会顧問の石川勉氏に感謝致します。また、ヨウ素学会会長の藤野隆氏や副会長の加納博文氏、ヨウ素学会理事・同事業委員会委員長の海宝龍夫氏、ヨウ素学会会員の浅倉聡氏から助言や支援を受け、伊勢化学工業(株)及び同社技術本部駒場美優氏や安藤剛氏らの協力を得てイラストレーションを作成することで、発行することができました。
ヨウ素学会事務局(2018年12月)記
- 1)はじめに
- 2)ヨウ素資源は如何に生成したか
- 3)ヨウ素はどのようにして製法されるか
- 4)ヨウ素含量は如何に分析されるか
- 5)ヨウ素にはどんな物理化学的性質があるか
- 6)ヨウ素による鉄の腐食を考える
- 7)ヨウ素の化学結合はどうなっているか
- 8)人工偏光板はどのような構造になっているか
- 9)超原子価ヨウ素化合物とはどんなものか
- 10)電導性ポリマーではヨウ素はどんな働きをしているか
- 11)有機金属はどんな構造をしているか
- 12)色素増感太陽電池の構造はどうなっているのか
- 13)甲状腺ホルモンは体内で如何に働いているのか
- 14)ヨウ素は消毒、殺菌、殺虫剤として如何に作用しているのか
- 15)医療に使われるヨウ素化合物にどんなものがあるか
- 16)ヨウ素の吸着が物質にどんな影響を与えるか
- 17)有機ヨウ素化合物はどのように利用されているか
- 18)ポリマー合成にヨウ素はどう関わっているか
- 19)ヨウ化金属が電池の材料になる
- 20)ヨウ化金属が有用な有機金属試薬をつくる
- 21)新しい物理的手法でヨウ素分子を見る
- 22)有用な天然物の合成に利用される
- 23)ヨウ素科学の新たな展開を考える
- 24)おわりに